- 江蘇省第二中醫(yī)院雨花濱江新院區(qū)醫(yī)療工(gōng)藝咨詢服務項目調研公告
- 2024年(nián)江蘇省中醫(yī)藥繼續教育項目“中西(xī)醫(yī)結合骨科治療新進展”學習班會議(yì)通(tōng)知
- 2024年(nián)國(guó)家級繼續教育項目“互聯網+護理服務”規範化管理學習班會議(yì)通(tōng)知
- 南京中醫(yī)藥大學第二附屬醫(yī)院、第二臨床醫(yī)學院2024年(nián)優秀大學生暑期夏令營活動通(tōng)知
- 江蘇省第二中醫(yī)院淨化工(gōng)程維保采購公告(第二次)
- 2024年(nián)南京中醫(yī)藥大學第二附屬醫(yī)院暑假社會實踐招募通(tōng)知
- 關于近期安全工(gōng)作(zuò)的通(tōng)知
- 2024年(nián)醫(yī)院夏令營招募通(tōng)知
江蘇省第二中醫(yī)院關于研究者發起的臨床研究管理流程
根據《醫(yī)療衛生機構開(kāi)展臨床研究項目管理辦法》(國(guó)衛醫(yī)發﹝2014﹞80号)要(yào)求,為(wèi)規範管理我院研究者發起的臨床研究,特制訂本流程。請(qǐng)各科室、部門按照管理流程要(yào)求開(kāi)展研究。
一(yī)、流程圖
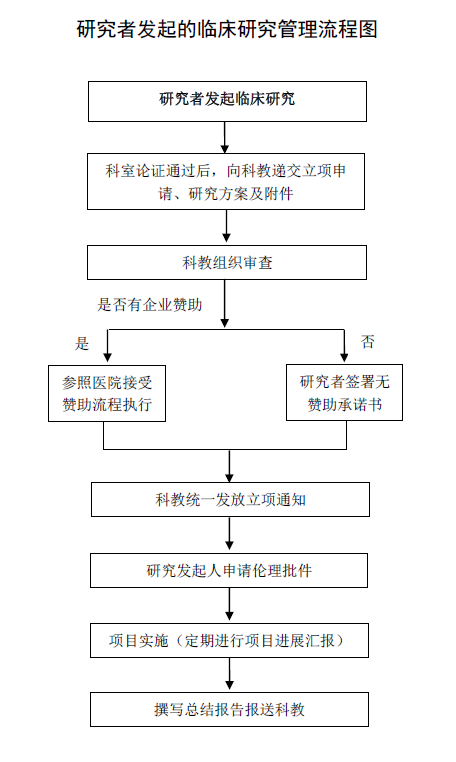
二、管理流程
1、研究發起人(rén)提出臨床研究申請(qǐng)
研究發起人(rén)拟定研究方案,填寫《研究者發起的臨床研究立項申請(qǐng)表》,科室組織專家(副高及以上(shàng))3人(rén)以上(shàng)論證其必要(yào)性、可(kě)行(xíng)性、科學性、風(fēng)險性等。科室審核通(tōng)過後提交至科教處。
2、形式審查
科教組織對研究小組成員(yuán)資質、研究方案及附件等進行(xíng)形式審查。
3、經費(fèi)審查
(1)無經費(fèi)贊助的項目,研究發起人(rén)填寫承諾書(shū),保證按規定期限完成研究。
(2)有企業經費(fèi)贊助的項目,須嚴格參照醫(yī)院管理要(yào)求接受贊助。
4、科教處立項
對于通(tōng)過審查的臨床研究,每月末科教處下(xià)達“關于江蘇省第二中醫(yī)院研究者發起的臨床研究立項通(tōng)知”。
5、倫理審查
立項通(tōng)過并涉及人(rén)體研究的項目,研究發起人(rén)須提交倫理審查相關文件至倫理委員(yuán)會,獲得倫理審查批件後開(kāi)展研究。
6、項目實施
(1)研究發起人(rén)嚴格遵照《藥物(wù)臨床試驗質量管理規範》、倫理批準的研究方案實施臨床研究。
(2)在研究過程中,若發生不良事件,研究發起人(rén)按照《不良事件和(hé)嚴重不良事件處理SOP》立即處理,并及時(shí)報送倫理委員(yuán)會及上(shàng)級衛生行(xíng)政管理部門。
7、質量管理
(1)研究發起人(rén)對本研究涉及的倫理以及受試者的安全、數(shù)據的真實性等負責。
(2)科教處根據項目情況檢查研究項目的質量和(hé)進度,對存在的問(wèn)題提出書(shū)面整改意見(jiàn),研究發起人(rén)應予以整改并給予書(shū)面答(dá)複。
8、總結報告
研究結束後,研究發起人(rén)撰寫“總結報告”,自(zì)行(xíng)邀請(qǐng)3名同行(xíng)專家評議(yì)(副高及以上(shàng)),科主任審核簽字後報告至科教處。
附件:
![]() 研究者發起的臨床研究無資金(jīn)贊助承諾書(shū).docx
研究者發起的臨床研究無資金(jīn)贊助承諾書(shū).docx
![]() 研究者發起的臨床研究工(gōng)作(zuò)流程圖.pdf
研究者發起的臨床研究工(gōng)作(zuò)流程圖.pdf






